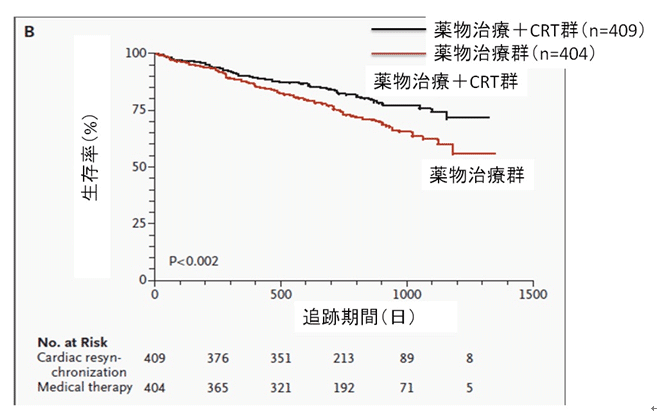
副次評価項目(ふくじひょうかこうもく、Secondary endpoint,ラテン語: secundus=「二番目の」)は、臨床試験の副次的な目的である。
臨床研究では、治療を受けたグループにおけるこれらの定義された基準の発現を、対照群における基準の発現と比較する。副次評価項目は、他の全ての評価項目と同様に、試験開始前に定義する必要がある。
O'Neillは、副次評価項目を次の様に定義している。
主要評価項目と副次評価項目の結果は、一般的に密接に関連している。試験の主要評価項目が明確な統計的有意性を示さない場合、副次評価項目を有効に分析する事が出来ない。
特に一次評価項目が主観的(ソフト)である場合、二次評価項目は一次評価項目をサポートする(ハードな)ものでなければならない。複数の副次評価項目がある事で、より信頼性の高い結果が得られる。
副次評価項目の例
試験で選択される副次評価項目は、試験の目的や治療対象となる疾患に大きく依存する。主要評価項目とは対照的に、副次評価項目にはソフトな、つまり測定不可能な基準が定義される事が多い。代表的な副次評価項目としては、患者の痛みやQOL等が挙げられる。また、安全性の評価項目である「忍容性」や「治療の安全性」も副次的評価項目として定義される事が多い。
三次評価項目
あまり頻繁ではないが、三次評価項目も研究で定義され得る。例えば、投与された薬剤がさらにプラスの「副作用」を齎す事が予想される場合等である。例えば、高血圧患者を対象としたASCOT試験では、「新たな糖尿病の発現」が三次評価項目として定義されている。
脚注
関連文献
- R. Temple: Current definitions of phases of investigation and the role of the FDA in the conduct of clinical trials. In: Am Heart J. 139/2000, S. 133–135.
- K. D. Weiss, J. P. Siegel: Issues in Endpoint Selection. In: Clinical Drug Trials and Tribulations. Marcel Dekker, New York 2002.
- P. M. Palevsky: Selection of endpoints for clinical trials of acute renal failure in critically ill patients. In: Current Opinion in Critical Care. 8/2002, S. 515–518.
関連項目
- p値
- 臨床評価項目
- 仮説検定